|
链霉亲和素磁珠链霉亲和素磁珠
产品简介 重庆渝恩素能科技有限公司提供的链霉亲和素磁珠,是由超顺磁性聚合微球与高纯度链霉亲和素(SA)共价结合而成,链霉亲和素-生物素(SA-Biotin)具有极高的结合亲和力 (Kd=10-15 mol/L),可高效结合生物素化抗体、核酸、蛋白等配体分子,在生物领域具有广泛的应用。本公司提供的1.0 μm链霉亲和素磁珠具有较高的链霉亲和素载量和极高的亲水性;具有良好单分散性、粒径均一性、超顺磁性,以及快速的磁响应速度;具有优异的重悬浮及分散能力,沉降速率低,有效确保高的抗体偶联量,有利于捕获目标分子及实现磁性分离,可满足不同试剂的研发和生产要求。
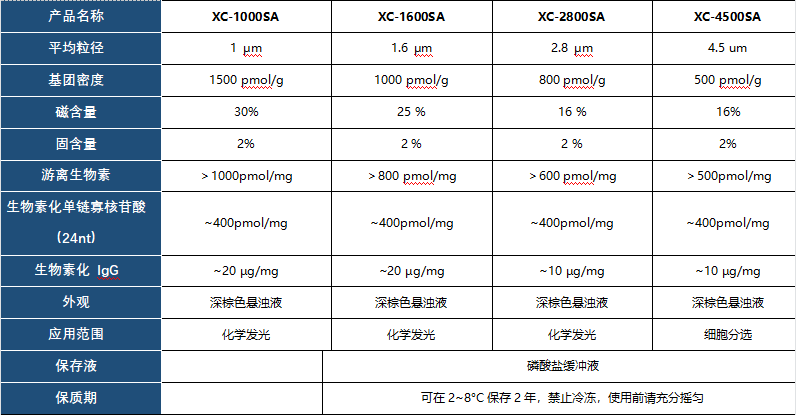
产品信息
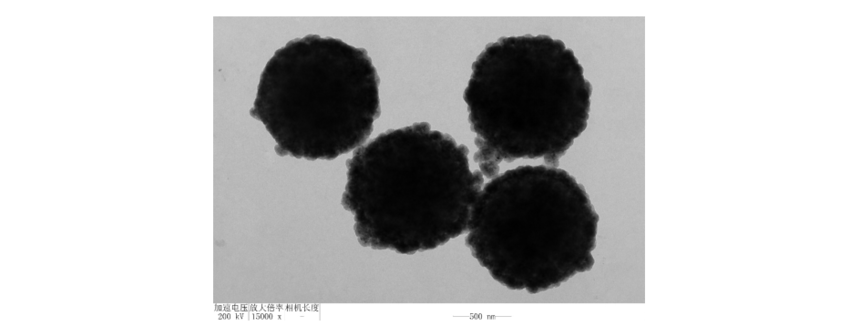
XC-1000SA 1μm 链霉亲和素磁珠 透射电镜图 链霉亲和素磁珠结合生物素化分子方案 1、常用的缓冲液: 1.1 Buffer I(生物素化核酸):10mM Tris-HCl (pH=7.5),1mM EDTA,1M NaCl,0.01%~0.1%Tween-20 1.2 Buffer II(生物素化蛋白):Tris或PBS(pH=7.4), 0.01% Tween-20,0.01%~0.1% BSA 2、结合生物素化核酸 2.1 将磁珠置于漩涡振荡器,让磁珠重悬分散。用移液器移取 200 μL 磁珠到新的离心管中。进行磁分离操作后去除上清液,取下离心管。 备注:取用的磁珠用量根据生物素化分子的量和磁珠的载量进行比例配置,建议比例为1-2 倍。 2.2 加入最少1 mL Buffer I (大于1ml时,和取用磁珠体积相等)到离心管中,盖上离心管盖,充分振荡重悬磁珠。磁分离操作后去除上清液。 2.3 重复“步骤 2.2”一次。 2.4 加入 500 μL 的用 Buffer I 稀释的生物素化核酸(使磁珠浓度为 2 mg/mL),充分振荡重悬磁珠。将离心管置于旋转混合仪上,室温旋转混合 30 min。 2.5 磁性操作后将上清液转移至新的离心管。 2.6 按“步骤 2.2”的方法洗涤磁珠三次。 2.7 根据后续实验的要求,加入合适的低盐缓冲液,重悬磁珠。至此结合生物素化核酸步骤完成。磁珠可用于后续操作。 2.8 用户可以通过测定反应前后核酸的浓度,计算结合到磁珠上的核酸量【(反应前浓度-反应后浓度)× 反应溶液体积】。 3. 结合生物素化蛋白操作流程 3.1 将磁珠瓶置于漩涡振荡器上 30 s,让磁珠重悬分散。用移液器移取 100 μL 磁珠到新的离心管中。进行磁分离操作后去除上清液,取下离心管。 备注:取用的磁珠用量根据生物素化分子的量和磁珠的载量进行比例配置,建议比例为1-2倍。 3.2 加入最少1 mL Buffer II (大于1ml时,和取用磁珠体积相等)到离心管中,盖上离心管盖,充分振荡重悬磁珠。磁分离操作后去除上清液。 3.3 重复“步骤 3.2” 两次,共洗涤三次。 3.4 加入 1 mL 用 Buffer II 稀释的生物素化蛋白(使磁珠浓度为 2-10 mg/mL),充分振荡重悬磁珠。将离心管置于旋转混合仪上,室温旋转混合 15-30 min。 3.5 磁性操作后将上清液转移至新的离心管。 3.6 按“步骤 3.2”的方法洗涤磁珠三次。 3.7 根据后续实验的要求,加入 Buffer II 或其他合适的缓冲液,重悬磁珠。至此结合生物素化蛋白步骤完成。磁珠可用于后续操作。
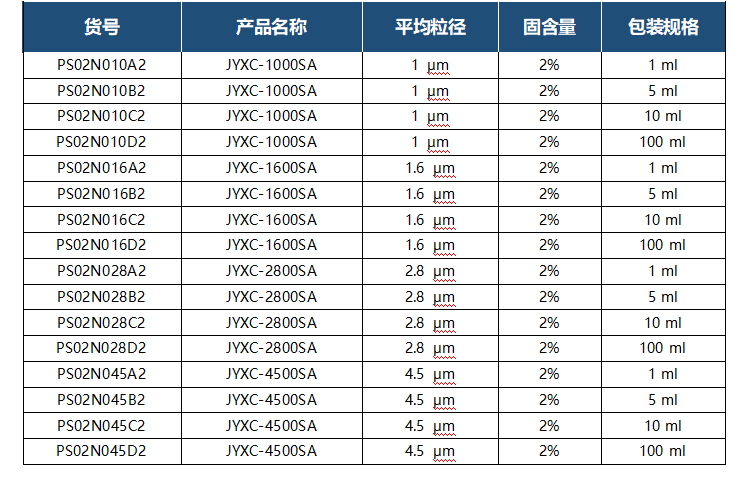
注意事项 1、磁珠不可冷冻; 2、每次磁性分离的时间应不少于 1 min。 3、移取磁珠前应充分震荡重悬均匀,操作过程中应避免产生气泡; 4、建议使用质量好的移液器吸头和反应管,避免因粘附磁珠及溶液而造成损失; 5、生物素化分子的大小会影响磁珠的载量,用户需要根据实验确定磁珠对特定生物素化分子的载量; 6、生物素化分子的加入量应为磁珠载量的 1~2 倍,以使磁珠饱和。 订货信息
上一篇羧基磁珠下一篇Protein A/G 抗体纯化磁珠 |

 产品与服务
产品与服务